Рандомізоване, плацебо-контрольоване, подвійне сліпе клінічне дослідження
Кодований номер протоколу клінічного випробування:
67652000PCR3002 (AMPLITUDE)
«Рандомізоване, плацебо-контрольоване, подвійне сліпе клінічне дослідження
3 фази препарату Нірапариб в комбінації з абіратерона ацетатом та преднізоном у порівнянні з абіратерона ацетатом та преднізоном для лікування пацієнтів з метастатичним кастрат-чутливим раком передміхурової залози (mCSPC) зі шкідливою гермінальною або соматичною мутацією генів, що відповідають за репарацію шляхом гомологічної рекомбінації (HRR)»,
Критерії включення пацієнтів до прескринінгу, які не мають проведених раніше результатів ані локального тесту, ані серійно проведеного спонсором дослідження тканини пухлини.
- Отримана прескринінгова інформована згода (письмової чи віддаленої/віртуальна).
- Вік ≥18 років (або місцевий юридичний вік згоди).
- Гістологічно підтверджена метастатична аденокарцинома передміхурової залози.
- Готові надати пухлинні тканини (архівований раніше або свіжий) для визначення шкідливої гермінальної або соматичної мутації генів HHR (більш детально дивись у таблиці 4 протоколу), якщо немає результатів локального тесту або проведеного раніше тесту, підтвердженого спонсором. (див. малюнок 2).
- Може надати зразок крові або слини для визначення соматичної мутації генів HHR.
Критерії включення в Скринінг:
Кожен потенційний учасник повинен відповідати всім перерахованим нижче критеріям для участі у дослідженні:
- Вік ≥ 18 років (або місцевий юридичний вік згоди).
- Діагноз аденокарциноми передміхурової залози.
- Метастатичне ураження, задокументоване наявністю ≥1 вогнищ у кістках остеосцинтиграфією з технецієм-99m (99mTc). Учасники з одиничним ураженням кісток повинні мати підтвердження метастазування кісток за допомогою КТ або МРТ.
- Повинен мати хоча б одну з шкідливих гермінальних або соматичних мутацій генів HHR, перелічених у таблиці 4 протоколу.
- Статус за ECOG ≤ 2.
- Андрогенна деприваційна терапія (медична або хірургічна кастрація) повинна бути розпочата принаймні за 14 днів до рандомізації і продовжуватися протягом фази лікування. Пацієнти, які починають лікування аналогами гонадотропін-вивільнюючого гормону (GnRHa) ≤ 28 днів до рандомізації, повинні будуть приймати анти-андроген першого покоління принаймні 14 днів до рандомізації. Анти-андроген повинен бути відмінений перед рандомізацією.
- Пацієнти, які отримували попереднє лікування доцетакселом, повинні відповідати наступним критеріям:
- Отримали максимум 6 циклів терапії доцетакселом для метастатичного гормон-чутливого раку простати,
- Отримали останню дозу доцетакселу ≤ 2 місяці до рандомізації,
- Зберігається відповідь на доцетаксел – стабілізація захворювання або краще, за оцінкою дослідником зображень та ПСА до рандомізації.
- Інша дозволена попередня терапія для метастатичного гормон-чутливого раку простати:
- Максимум 1 курс променевої терапії або хірургічне втручання з метою зменшення проявів симптомів раку простати. Опромінення з метою лікування не допускається. Опромінення має бути завершене до рандомізації.
- ≤ 6 місяців адрогенної деприваційної терапії (АДТ) до рандомізації.
- 30 днів терапії за схемою Абіратерона Ацетат + Преднізон (АА-Р) допускається за необхідністю.
- Допускається попереднє лікування локалізованого раку передміхурової залози (всі методи лікування мають бути завершені ≥ 1року до рандомізації):
- ≤3 років загальна тривалість АДТ;
- Всі інші методи попередньої терапії, включаючи променеву терапію, простатектомію, дисекцію лімфатичних вузлів та системну терапію.
- Показники лабораторних аналізів на Скринінгу:
- Абсолютне число нейтрофілів ≥1,5х109/л;
- Гемоглобін ≥ 9,0 г/дл, незалежно від переливання протягом щонайменше 28 днів;
- Тромбоцити ≥100х109/л;
- Креатинін ≤ 2.0 х верхня межа норми (ULN);
- Сироватковий калій ≥ 3,5 ммоль/л;
- Загальний сироватковий білірубін ≤1.5 х ULN або прямий білірубін ≤1 х ULN (Примітка: пацієнтам з синдромом Жільбера, у яких загальний білірубін у >1.5 рази вище верхньої межі норми, слід виміряти прямий і непрямий білірубін, і, якщо прямий білірубін у ≤1.5 рази вище від ULN, пацієнт може бути придатним за оцінкою медичного монітора);
- Аланінамінотрансфераза (АЛТ) або аспартатамінотрансфераза (АСТ) ≤ 3 x ULN.
- Здатні ковтати таблетки досліджуваного препарату цілими.
- Кожен пацієнт повинен підписати форму інформованої згоди (письмово чи віддалено/віртуально), у якій вказується, що він розуміє мету дослідження та процедури, яких воно потребує, а також його бажання приймати участь у дослідженні, включаючи надання зразка ДНК.
- Під час прийому досліджуваного препарату та протягом 3 місяців після останньої дози досліджуваного препарату учасник чоловічої статі повинен погодитися використовувати адекватний метод контрацепції, який дослідник визнає доцільним та як зазначено у Розділі 5.3. Міркування щодо способу життя. Учасники-чоловіки повинні дати згоду не бути донором сперми для репродуктивних цілей під час досліджування та протягом 3 місяців після останньої дози досліджуваного препарату.
- Учасник чоловічої статі повинен погодитись не здавати сперму під час лікування та протягом як мінімум 3 місяців після останньої дози досліджуваного препарату.
Критерії виключення:
Будь-який потенційний учасник, який відповідає будь-якому з наведених нижче критеріїв, буде виключений з участі у дослідженні:
- Патологічні знахідки, що відповідають дрібноклітинній протоковій чи нейроендокринній карциномі.
- Попереднє лікування PARP інгібіторами (ПАРП – полі(аденозин-дифосфат[АДФ] рибози) полімераза).
- Попередня AR-таргетна терапія (наприклад, кетоконазол для раку передміхурової залози, апалутамід, ензалутамід, даролутамід), імунотерапія або радіофармацевтичні засоби, за винятком лише 30 днів АА-Р, дозволених до рандомізації.
- Початок лікування бісфосфонатами або деносумабом для лікування метастазів у кістки ≤ 28 днів до рандомізації.
- Дисфункція наднирників в анамнезі.
- Довготривале системне використання кортикостероїдів (> 5 мг преднізону або його еквівалент) під час дослідження не допускається. Допускається короткочасне використання (≤4 тижні) та місцеве застосування стероїдів (наприклад, інгаляційні, місцеві, офтальмологічні та внутрішньосуглобові), якщо це клінічно показано.
- Активні злоякісні новоутворення (тобто прогресуючі або потребують зміни лікування протягом останніх 24 місяців), окрім захворювання, яке лікується під час дослідження. Єдині дозволені винятки:
- нем’язево- інвазивний рак сечового міхура;
- рак шкіри (немеланома або меланома), який лікували протягом останніх 24 місяців і вважається повністю вилікуваним;
- рак молочної залози – адекватно лікована лобулярна карцинома in situ або протокова карцинома in situ;
- злоякісне захворювання, яке вважається вилікуваним з мінімальним ризиком рецидиву.
- Наявність в анамнезі або наявний діагноз мієлодиспластичного синдрому (MDS) /гострої мієлоїдної лейкемії (AML).
- Поточні прояви протягом 6 місяців до рандомізації будь-чого з наступного: тяжка/нестабільна стенокардія, інфаркт міокарду, симптоматична застійна серцева недостатність, клінічно значимі артеріальні чи венозні тромбоемболічні випадки (наприклад, легенева емболія) або клінічно значимі шлуночкові аритмії.
- Наявність тривалої неконтрольованої гіпертензії (систолічний артеріальний тиск >160 мм рт.ст. або діастолічний артеріальний тиск >100 мм рт.ст.). Пацієнтам з гіпертонічною хворобою в анамнезі дозволяється участь у дослідженні за умови контролю артеріального тиску в цих межах антигіпертензивним лікуванням.
- Відома алергія, гіперчутливість або непереносимість нірапарибу, абіратерону та нірапариб/АА FDС або відповідних допоміжних речовин (зверніться до брошур дослідника нірапариб та АА).
- Наявність підтвердженого будь-якого медичного стану, при якому протипоказано використано преднізона.
- Проведене втручання з метою дослідження (включаючи досліджувані вакцини) або застосований інвазивний досліджуваний медичний прилад протягом 30 днів до запланованої першої дози досліджуваного препарату.
- Учасники яким виконано наступні процедури ≤28 днів до рандомізації:
- Переливання (тромбоцити або еритроцити);
- Гематопоетичні фактори росту;
- Велике хірургічне втручання (слід звернутися до спонсора щодо того, що являє собою в їх розумінні велике хірургічне втручання).
- Вірус імунодефіциту людини (ВІЛ) у позитивних пацієнтів (досліджуваних) з 1 чи більше показаннями:
- не отримуючи високоефективну антиретровірусну терапію або на антиретровірусної терапії менш ніж 4 тижня.
- отримання антиретровірусної терапії що може взаємодіяти з препаратом дослідження (за винятком випадків, коли після консультації зі спонсором щодо критерію виключення 16.b вноситься зміна, щоб уникнути можливої взаємодії лікарських засобів з досліджуваним препаратом).
- зміна антиретровірусної терапії протягом 6 місяців від початку скринінгу (крім випадків, після консультації з спонсором.
- кількість CD4 <350 на момент скринінгу.
- синдром набутого імунодефіциту, що супроводжується опортуністичною інфекцію протягом 6 місяців після початку скринінгу
- навантаження вірусу імунодефіциту людини (ВІЛ) > 400 копій / мл.
- Активний або симптоматичний вірусний гепатит або хронічне захворювання печінки; енцефалопатія, асцит або порушення кровотечі, спричинені порушенням функції печінки.
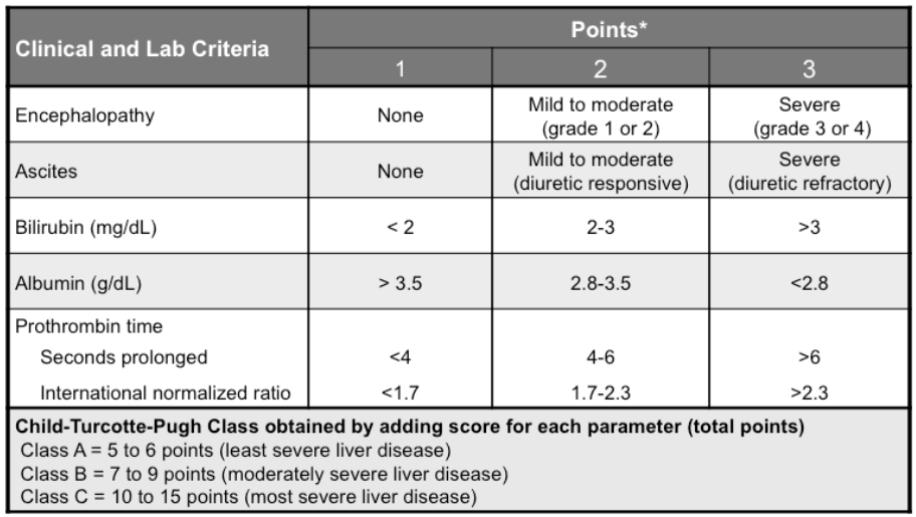
- Серйозні порушення функції печінки класу С за системою класифікації Чайлда-П’ю (Додаток 9).
Додаток 9 Класифікація Чайлда-П’ю
Науково-дослідне відділення пластичної та реконструктивної онкоурології
Головний дослідник: Стаховський Едуард Олександрович
Співдослідник: Вітрук Юрій Васильович, тел. +38(050)6732082
Співдослідник: Семко Софія Леонідівна, тел. +38(063)2526536
Недавні записи
- Чудова новина — Ілля завершив лікування та повернувся додому! 11 Липня, 2025
- Пам’ятаймо медиків, які загинули, рятуючи інших 10 Липня, 2025
- Академія освіти ДНП «НІР»: відбулися тренінги з оволодіння практичними навичками з лапароскопічної хірургії 8 Липня, 2025
- Участь у Euro Master Course: міжнародний досвід у сфері дитячої онкології 8 Липня, 2025
- Ендоскопічні обстеження – точність, що рятує життя! 2 Липня, 2025

